Проблема: кислотность почвы
От реакции почвы зависят доступность растениям макро- и микроэлементов, эффективность удобрений, активность и групповой состав почвенной микрофлоры, скорость минерализации растительных остатков и химического выветривания почвенных минералов и другие процессы.
Реакция почвенного раствора разных почв зависит от состава поглощенных катионов. Кислая реакция почвы обычно характерна для влажного климата с промывным водным режимом. В районах с умеренным климатом почвы под луговыми травами имеют меньшую кислотность, чем почвы, занятые хвойными лесами.
Реакция любого раствора обусловливается соотношением концентраций ионов водорода [Н+] и гидроксида [ОН-].
Для удобства (чтобы записи не были громоздкими) концентрацию (активность) водорода в разбавленных растворах лучше выражать в виде отрицательной показательной функции. Обычно кислотность растворов выражают через pH — водородный показатель, который численно равен отрицательному логарифму концентрации (активности) Н+, выраженной в молях на литр:
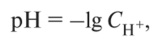
Показатель pH служит критерием кислотности и щелочности раствора, а концентрация ионов Н30+ (Н+) в чистой воде при 25 °С является эталоном нейтральной реакции раствора (нейтральной точкой pH).
Кислотность почвы обусловлена наличием ионов водорода в почвенном растворе и обменных ионов водорода и алюминия в почвенном поглощающем комплексе. Концентрация ионов водорода (Н+) и гидроксида (ОН-) в почвенном растворе может составлять 10-3 — Ю-10 М/л (г-экв/л). Раствор считается кислым, если концентрация ионов Н+ больше концентрации ОН-. Следовательно, если pH < 7, то реакция раствора кислая, при pH = 7 — нейтральная, при pH > 7 — щелочная.
В агрохимической практике кислые и нейтральные почвы в зависимости от реакции среды (рНКС|) принято выделять в следующие группы: очень сильнокислые (рНКС]< 4,0); сильнокислые (4,0—4,5), среднекислые (4,5—5,0); слабокислые (5,0—5,5); близкие к нейтральным (5,5—6,0). Щелочность почв определяют в водной вытяжке (рНн,0). Их подразделяют на слабощелочные (pHHi0 7,5—8,0), среднещелочные (8,0—8,5) и сильнощелочные (8,5—10,6).
Чистая вода, как отмечалось, содержит 10-7 моль/л ионов Н+, а ее pH равен 7. При контакте воды с атмосферным воздухом, содержащим 0,03 об. % СО, (массовая доля 0,046%), происходит поглощение диоксида углерода водой с образованием слабого раствора угольной кислоты (pH 5,6). Такое значение pH обычно имеет дистиллированная вода в лабораториях, так как в ней растворяется СО,, входящий в состав воздухе. Дождевая вода, наряду С02, содержит гидратированные оксиды азота (NO, N203, N02) и серы (S02 и S03), образующие азотную и серную кислоты, поэтому pH такой воды обычно ниже — 4—5. В процессе инфильтрации атмосферных осадков в нижние горизонты почвенного профиля ионы водорода, содержащиеся в воде, вытесняют из ППК основания, и в результате их выщелачивания происходит постепенное подкисление почвы. Кислые атмосферные осадки являются внешним источником кислотности.
Внутренние источники кислотности почв многообразны и обусловлены протекающими в них биологическими и химическими процессами. Одной из причин подкисления почв является жизнедеятельность растений и микроорганизмов. Корни растений и микрофлора в процессе дыхания выделяют значительное количество С02, который, растворяясь в почвенном растворе, образует Н2С03. Угольная кислота довольно слабая (К = 5 • 10-5), она заметно диссоциирует лишь при pH > 5, а поэтому может быть важным источником Н+ лишь для нейтральных и щелочных почв.
Данные о выделении С09 из парующей разноокультуренной дерново-подзолистой почвы и почвы, засеянной кукурузой, позволяют судить о значении микрофлоры и растений в продуцировании угольной кислоты.
Наряду с дыханием, корневая система растений и почвенная микрофлора в процессе жизнедеятельности выделяют в почву различные органические кислоты (экссудация карбоновых и аминокислот), подкисляющие почвенный раствор. Размер таких выделений за вегетационный период, по данным разных авторов, составляет 50—200 кг/га.
Значительное количество Н+ образуется в процессе минерализации растительных остатков и гумусовых веществ до органических и минеральных (HN03, H2S04, Н3Р04) кислот.
Корни растений в ходе поглощения элементов питания выделяют ионы Н+ и НС03“, следовательно, они могут быть источником как кислот, так и оснований.
Наряду с минеральными и органических кислотами, большое подкисляющее действие на почвенный раствор оказывают алюминий, железо, марганец и их соли:
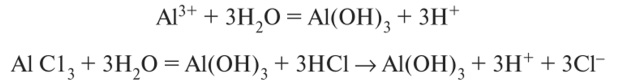
Содержание подвижного алюминия в почвенном растворе при pH > 5 обычно незначительно, и кислотность почвы обусловливается в основном ионами Н+, однако его роль становится доминирующей в сильнокислых почвах в связи со значительным увеличением растворимости А1(ОН)3 при pH < 5 и высвобождением алюминия из кристаллической решетки глинистых минералов. Если содержание в почве подвижного алюминия составляет более 20 мг/кг, то он оказывает токсическое действие на рост и развитие большинства сельскохозяйственных культур. Наиболее чувствительны к алюминию овес, кукуруза, люцерна и сахарная свекла. Токсичности алюминия можно избежать, поддерживая pH почвы на уровне выше 5,5.
Многие минералы (алюмосиликаты и силикаты) при химическом выветривании образуют гидроксиды (А1(ОН)3, Fe(OH)3, H4Si04 и др.), являющиеся причиной подкисления почв.
Сельскохозяйственное использование земель существенно нарушает равновесие между поступлением и выносом оснований. Распашка естественной растительности и обработка почв вызывают активизацию микробиологических процессов, ускоренное разложение органического вещества и развитие кислотности. Влияние растительности на pH почвы носит неоднозначный характер. С одной стороны, образующиеся при разложении растительных остатков различные органические кислоты подкисляют почву, с другой — повышение гумусированности почвы за счет растительных остатков увеличивает емкость поглощения, что предотвращает вымывание оснований из почвы.
Кроме того, растения в значительной степени компенсируют выщелачивание, перехватывая корневой системой элементы питания из подпахотных слоев почвенного профиля. Питательные вещества, получаемые растениями из всех горизонтов корнеобитаемого слоя почвы, перераспределяются преимущественно в надземные органы растений и превосходящую по массе верхнюю часть корней, после отмирания которых большая часть элементов питания вновь возвращается в верхний (пахотный) слой почвы.
Значительное влияние на подкисление почвы оказывают минеральные удобрения — азотные, калийные и комплексные, не содержащие кальция или магния. Подкисляющее действие удобрений связано, с одной стороны, с пропорциональным урожаю увеличением выноса из почвы оснований (Са, Mg) (табл. 2.3). Применение минеральных удобрений увеличивает урожайность сельскохозяйственных культур, а следовательно, отчуждение оснований с товарной частью урожая. Если при внесении удобрений урожай сена клевера увеличился в 3 раза, предположим с 2 до 6 т/га, то суммарное отчуждение кальция и магния также возрастает примерно в 3 раза — с 50—60 до 140—180 кг/га.
С другой стороны, вымываемые из почвы внесенные с азотными и калийными удобрениями «балластные» анионы (СГи S042-) при их вымывании из почв вовлекают в этот процесс эквивалентное количество катионов (в основном Са2+ и Mg2+).
В интенсивных овощных севооборотах потери кальция из почвы в результате отчуждения его с урожаем и вымывания составляют 200—300 кг/га, что приводит к интенсивному подкислению почвы и необходимости повторного известкования почв через 4—5 лет.
Заметное подкисление почвы вызывают систематическое применение физиологически кислых удобрении (NH4C1, (NH4)2S04, КС1 и K2S04), а также нитрификация аммонийных, амидных ((NH2)2CO) и аммиачных (NH3) удобрений.
При внесении извести, металлургических шлаков, фосфоритной муки и физиологически щелочных азотных удобрений (NaN03 и Ca(N03)2) происходит нейтрализация почвенной кислотности.
Таблица 2.3
|
Культура |
Вынос с урожаем, кг на 1 т продукции (в пересчете на карбонаты)** |
||
|
СаС03 |
MgC03 |
||
|
Озимая рожь* |
8,8 |
6,0 |
|
|
Озимая пшеница* |
6,3 |
6,5 |
|
|
Яровая пшеница* |
5,6 |
7,8 |
|
|
Яровой ячмень* |
7,7 |
6,3 |
|
|
Овес* |
9,7 |
7,2 |
|
|
Гречиха* |
18,0 |
8,5 |
|
|
Горох* |
31,5 |
10,0 |
|
|
Лен-долгунец* |
17,1 |
16,4 |
|
|
Сахарная свекла(корни) |
2,9 |
1,3 |
|
|
Картофель(клубни) |
0,5 |
1,5 |
|
|
Кормовые корнеплоды |
0,5 |
1,0 |
|
|
Кормовой люпин (зеленая масса) |
2,9 |
1,5 |
|
|
Клевер красный (сено) |
42,2 |
19,0 |
|
|
Люцерна |
45,5 |
7,8 |
|
|
Многолетние травы (сено) |
27,0 |
12,5 |
|
|
Однолетние бобовые травы (сено) |
30,0 |
10,6 |
|
|
Капуста |
1,3 |
0,8 |
|
|
17,1 |
10,2 |
|
|
7,5 |
5,0 |
|
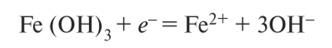
Обменная кислотность обусловливается наличием в твердой части почвы (в ППК) ионов водорода и алюминия (в сильнокислых почвах — железа и алюминия) в обменном состоянии, которые вытесняются при взаимодействии нейтральной соли с почвенным поглощающим комплексом:
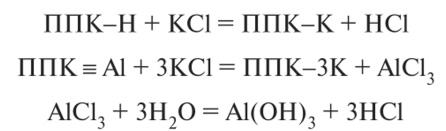
При более высоком значении pH образуется слаборастворимый гидроксид А1(ОН),.
Торфяные и песчаные почвы практически не содержат обменного алюминия. При внесении в почву удобрений, содержащих кислоты в почвенном растворе, остается лишь часть добавленных ионов Н+, остальные поглощаются ППК в обмен на основания, и наоборот, если в почву внесены щелочные удобрения, то основания; почвенного раствора вытесняют Н+ из ППК (меняются местами) и тем самым снижают обменную кислотность почвы.
Гидролитическая кислотность почвы обусловливается ионами водорода и алюминия, вытесняемыми из ППК 1 М раствором гидролитически щелочной соли ацетата натрия. В результате гидролиза CH3COONa образуется слабая уксусная кислота и сильное основание — гидроксид натрия, pH такого раствора равен 8,2:
CH3COONa + Н20 S СН3СООН + NaOH ППК-Н + NaOH + СН3СООН = ППК-Na + Н20 + СН3СООН
Раствор ацетата натрия обладает буферными свойствами, он способен поддерживать заданное значение pH.
Гидролитическая кислотность торфяно-болотных почв обусловлена в основном ионами Н+, поэтому они менее токсичны по сравнению с минеральными почвами, несмотря на значительно большую величину гидролитической кислотности этих почв.
Определение гидролитической кислотности имеет важное практическое значение для решения вопросов фосфоритования и известкования кислых почв.
Одномолярным раствором CH3COONa вытесняются далеко не все потенциальные ионы Н+почвы, а лишь та их часть, которая при pH 8,2 способна к диссоциации, а следовательно, и к обмену. Большая часть потенциальных ионов водорода при данном значении реакции среды находится (остается) в составе многочисленных недис- социированных функциональных групп ПИК, которые при неизменных условиях в течение многих лет могут оставаться в молекулярной (недиссоциированной) форме, не участвовать в обменных процессах, а следовательно, и не оказывать какого-либо отрицательного влияния на растения.
Поскольку емкость обмена в значительной мере обусловлена рН- зависимыми карбоксильными (R-COOH = R-COCT+ Н+), фенольными и спиртовыми (R-OH = R-0- + Н+), гидроксидными функциональными группами органических коллоидов, группами R-Si-OH = R-Si-СГ + Н+; А1(ОН)3 = А1(ОН)2+ + Н+, Fe(OH)3 = = Fe(OH)2+ + Н+ и других минеральных коллоидов почвы, повышение pH раствора увеличивает степень их диссоциации и переход ионов водорода в раствор.
Негативное действие ионов Н+ и А13+ на растения зависит не только от их содержания в почве (мг-экв/100 г), но и от их доли (%), занимаемой в составе поглощенных катионов, — степени насыщенности ЕКО основаниями (Са2+, Mg2+, К+ и Na+).
По Д. Хиссинку, степень насыщенности почв основаниями показывает, какая часть (доля) ЕКО приходится на поглощенные основания:
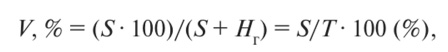
где V — степень насыщенности основаниями (%); S — сумма поглощенных оснований, мг-экв/100 г почвы; Нг — гидролитическая кислотность, мг-экв/100 г почвы; Т — емкость катонного обмена (ЕКО = Т= S + Нг, мг-экв/100 г почвы).
Почвы, не насыщенные основаниями (дерново-подзолистые, серые лесные, торфяно-болотные, красноземы, оподзоленные и выщелоченные черноземы), содержат определенное количество Н+ и А13+, для них Т> S. Для этих почв характерно присутствие не только обменного, но и растворимого алюминия. В зависимости от минералогического состава почвы содержание обменного А13+ может составлять от 2 до 10 мг-экв/100 г почвы.
Определение степени насыщенности основаниями (V, %) необходимо для принятия решений о нуждаемости почв в известковании.
Почвы степных и сухостепных районов (черноземы обыкновенные, каштановые почвы, сероземы), а также кислые почвы после известкования насыщены основаниями, для этих почв Vдостигает 100%, aT~S.
Кислотно-основная буферность почвы — ее способность противостоять изменению pH почвенного раствора при взаимодействии почвы с кислотами и основаниями. Например, для карбонатных почв характерна высокая буферная способность в отношении подкисления, для кислых почв — в отношении подщелачивания. Почвы тяжелого гранулометрического состава менее подвержены изменению кислотности; песчаные почвы отличаются слабой буферностью к любому внешнему воздействию. Таким образом, почвы существенно различаются по своей устойчивости к подкислению или подщелачиванию. Эти особенности почв имеют значение для сельскохозяйственного производства, поскольку для устранения кислотности песчаных почв требуется значительно меньше извести, чем для устранения кислотности почв тяжелого гранулометрического состава.
Избыточная кислотность почвы, особенно при высоком содержании активного алюминия, является одной из главных причин низкой продуктивности сельскохозяйственных культур.
Изменение кислотности почв
Одной из важных характеристик почв является их кислотность. Она определяется содержанием ионов Н+ и А13+ в почвенных растворах. Кислотность почв выражают через величину pH — отрицательный логарифм концентрации ионов Н+ в почвенном растворе. Показатель pH может изменяться от 0 до 14, в природе диапазон его варьирования — от 2,5 до 12,5. В естественных условиях наиболее кислыми субстратами являются олиготрофные сфагновые торфяники и силыюоподзолеииые почвы. Сильнокислой реакцией обладают также латеритные коры выветривания желтоземы и красноземы. Щелочная реакция почвенных растворов характерна для солодей, содержащих в почвенном поглощающем комплексе Na. Нейтральная и близкая к пей реакция среды, наиболее оптимальная для развития большинства живых организмов, отмечается в черноземах и дериово-карбоиатиых почвах. Изменение величины pH почвенных растворов происходит при различных антропогенных воздействиях: сельскохозяйственном использовании земель, заболачивании территорий, выпадении кислотных дождей, аэротехиогеииых выпадениях и т. п.
В процессе развития живые организмы приспособились к обитанию в определенных кислотно-щелочных условиях. Для определения кислотности почв и изменения ее под влиянием природных и антропогенных факторов удобнее всего применять ин- дикакториые виды растений и особенности состава фитоцеиозов. В экологии растений существует следующая классификация видов по отношению к pH окружающей среды: ацидофилы — растения, произрастающие на кислых почвах; базифилы — растения, произрастающие на щелочных почвах; нейтрофилы — растения почв с нейтральной реакцией.
Приуроченность растений к почвам с определенным значением pH дает возможность использовать растительность в качестве индикатора кислотно-щелочных условий почвенных растворов (табл. 30). Индикаторная значимость видов указана для растений, проективное покрытие которых превышает 80%.
Биоиндикация процессов закисления, нейтрализации или подщелачивания почвенных растворов проводится с использованием фитоиидикаторов кислотности почв, а также изменения видового состава биоценоза и его динамики во времени. Так, например, на территории Канско- Ачинского топливно-энергетического комплекса индикатором щелочного сульфатно-кальциевого загрязнения среды является хлороз хвои сосны, а в травяном покрове — замещение кальцефобов-ацидофилов (грушапка круглолистная Pyrola rotundifolia, ожика волосистая Lusula pilosa и др.) па базифилы-кальцефилы (бобовые, орхидные, злаки) и виды широкого экологического спектра. Выносливыми к щелочной среде оказались тысячелистник обыкновенный и овсяница луговая (Нечаева и др., 2011).







